Амонякът (NH3) е безцветен газ, който се състои от азот и водород. Има остра миризма, която често се сравнява с почистващи химикали. Амонякът се създава в почвата от бактериални дейности като част от цикъла на азота.
Амонякът може да се намери във въздуха, почвата и водата, както и в растенията и животните, включително хората. Много домашни и търговски перилни препарати също съдържат амоняк. Амонякът може да раздразни и изгори кожата, устата, гърлото, белите дробове и очите при високи нива. Изключително високите нива на амоняк могат да причинят смърт или увреждане на белите дробове. Излагането на амоняк може да причини нараняване на работниците. Степента на експозиция се определя от дозата, продължителността и вида на извършената работа.
Няколко факта за амоняка:
- Получава се естествено, когато органичните вещества, включително като растения, животни и животински екскременти, се разлагат.
- Амоняк В сухи ситуации газът е по-лек от въздуха; но при мокри/влажни условия могат да се образуват амонячни пари, които са по-тежки от въздуха.
- Може да предизвика изгаряне на очите, носа и дихателните пътища, което може да доведе до увреждане на белите дробове или смърт.
- Въпреки че амонякът не е много запалим, той може да експлодира, когато е подложен на висока температура.
Забавен факт – амонякът е част от цикъла на азота и се произвежда в почвата от бактериални процеси.


Въглеродният диоксид (CO2) е безцветен газ с кисел вкус и лека остра миризма. Той е един от най-важните парникови газове, свързани с глобалното затопляне, но е второстепенен компонент на земната атмосфера (около 3 обема на 10 000), образуван при изгарянето на въглерод-съдържащи материали, ферментация и дишане на животните и се използва от растения при фотосинтеза на въглехидрати.
Ян Баптиста ван Хелмонт, белгийски учен, идентифицира въглеродния диоксид като отделен газ в началото на 17 век, след като го наблюдава в резултат както на ферментация, така и на изгаряне. При 31 °C (87,4 °F) той се втечнява до 75 килограма на квадратен сантиметър (1071 паунда на квадратен инч) или 16–24 kg на квадратен см (230–345 фунта на квадратен инч) при 23–12 °C (10–10 °F). Въглеродният диоксид се използва като хладилен агент, за надуване на спасителни салове и спасителни жилетки, за взривяване на въглища, за порест каучук и пластмаси, за насърчаване на растежа на растенията в оранжерии, за обездвижване на животни преди клане и за производство на газирани напитки.
Забавен факт – Въглеродният диоксид се използва за разпределяне на бира.
Непълното изгаряне на горивата произвежда въглероден окис (CO), газ без мирис и цвят. Когато хората са изложени на CO газ, CO молекулите в телата им изместват кислорода, причинявайки отравяне.
Нашите сетива не могат да идентифицират въглеродния окис, тъй като той няма мирис, цвят или вкус. В резултат на това смъртоносни нива на газ могат да се натрупат на закрито, като хората няма как да открият проблема, докато не се разболеят. Освен това симптомите на отравяне с CO са подобни на тези на грипа, което кара страдащите да пренебрегват ранните признаци на отравяне с CO.
Въглеродният окис може да бъде произведен от
- Сушилни, бойлери, бойлери, газови фурни, коли, генератори, тютюн и други!
- Симптомите включват главоболие, задух, гадене, объркване, нарушена координация и дори по-сериозна загуба на съзнание.
- Въглеродният окис започва да кипи при -191,5 °C
Забавен факт – „Въглеродният окис е тихият убиец, тъй като не можете да го вкусите или помиришете.“



Хлорът (Cl2) е газ, който изглежда зелен/жълт и има остра, задушлива миризма, свързана с миризмата на белина. Хлорът е в семейството на халогените, заедно с флуора, брома и йода. Това е токсичен и корозивен газ, който може да раздразни очите и дихателната система на човека. Хлорът не гори, но поддържа горенето, подобно на кислорода.
Създаването на хлор датира от присъствието на каменни соли (халогенни соли) преди хиляди години, основната съставка на солта, разтворена в морска вода. В римско време химик на име Йохан Рудолф Глаубер нагрява сол в пещ на дървени въглища и кондензира изпаренията, за да създаде газ. Това е газ, който сега познаваме като солна киселина. След като открива солна киселина, друг химик на име Карл Вилхелм Шееле комбинира новооткрития газ с черен оксид с манган и създава зелен/жълт газ. Въпреки че е открит от Карл, това е Хъмфри Дейви – английски химик, който по-късно наименува откритието на газа – Хлор.
- Хлорът съществува естествено в малки количества във вулканични газове под формата на химически съединения.
- Най-разпространеното съединение на хлора е натриевият хлорид, който се намира в кристалната каменна сол в морската вода – предимно в Мъртво море и солените езера.
- Хлорът може да се намери в малки количества в човешкото тяло в нашата кръв.
- Хлорът става течност при -34 градуса.
- Хлорът е най-известен с употребата си в плувни басейни, тук се използва за стерилизиране на вода за защита на хората от холера и коремен тиф.
Забавен факт – Името „хлор“ произлиза от гръцката дума „хлорос“, което означава „жълтозелено“.
Водородът (H2) е първият елемент в периодичната таблица. Това е най-основният атом, състоящ се от един протон в ядрото, около което се върти един електрон. Най-лекият от елементите, водородът, е и най-разпространеният във Вселената. При типични температури и налягания водородът е газ без цвят, мирис и вкус. Освен това е изключително запалим, с неоткриваем пламък.
Тъй като водородът е силно запалимо гориво, течовете представляват значителен риск от пожар. От друга страна, пожарите, подхранвани от водород, се различават от тези, подхранвани от други горива. Тежки горива и въглеводороди, като бензин и дизел, се събират близо до почвата, когато се разлеят. Тъй като това е един от най-леките елементи на планетата, когато възникне изтичане, той веднага се разпръсква нагоре. Въпреки че водородът не е токсичен, той може да се натрупа в затворени места като помещения за съхранение на батерии и да причини задушаване чрез изместване на кислорода. Освен това водородът се запалва и гори по-бързо от бензина или дизела. Ако водородът е достъпен, дори електрическа искра от човешки пръст ще бъде достатъчна.
Забавен факт – „Водородът е единственият елемент, който може да съществува без неутрони“

Сероводородът (H2S) е безцветен газ, но има много силна миризма на развалени яйца. Това е задушлив, запалим и експлозивен газ, което го прави опасен газ. H2S съществува естествено и се произвежда от човешки и животински отпадъци, съществува естествено във вулканични газове и е страничен продукт от промишлена дейност. Той е много токсичен при вдишване. H2S има точка на топене -85,7 по Целзий и точка на кипене -60,2 по Целзий.
H2S засяга значително човешкото тяло в нервната и сърдечно-съдовата система; най-вероятно е да се вдиша или да влезе в контакт с човешкото тяло през очите или кожата. Ако някой издържи продължително излагане на H2S, той в крайна сметка ще загуби способността да го помирише. Освен това, ако газът е в много висока концентрация, способността да го помиришете се премахва моментално. Водородният сулфид съществува естествено в суров петрол, природен газ, вулканичен газ и горещи извори. Използва се и за производство на сярна киселина, сяра, пестициди, кожа и тежка вода за ядрени централи.
Забавен факт – Много малко количество сероводород се произвежда от бактерии в устата ни.
Метанът като газ е безцветен и без мирис. Той обаче е силно запалим. Съединението е направено от въглерод-водород. Метанът е слабо разтворим във вода и лесно изгаря във въздуха, за да образува въглероден диоксид и водна пара. Един от най-значимите рискове от метана е неговата запалимост, тъй като може да причини смъртоносни експлозии, водещи до бедствия в затворени пространства като мини.
Метанът (CH4) е общоизвестен като парников газ, който има отрицателно въздействие върху околната среда, като допринася за повишаването на температурата на земята. Метанът, заедно с етана и пентана, е въглеводород и е вторият най-разпространен антропогенен (причинен от човека) газ – въглеродният диоксид е най-много. Метанът е основният компонент на природния газ и биогаза. Природният газ се състои от въглеводороди – метан, бутан, етан, пропан. Индустрии като строителството често са изложени на висок риск от излагане на природни газове, тъй като те съществуват в различни слоеве в земята. Следователно, когато се разкопават строителни обекти, работниците трябва да внимават за риска от тези газове.
Метанът се използва силно в домашни условия и е най-популярният газ, предоставян на обществото за централно газиране, отопление и готвене в домовете им. Метанът съществува от;
- Дейности, свързани с човека – отглеждане на добитък, изтичане на газ, сметища, отпадъци, добив на въглища
- Природен газ, който се използва за захранване на домове и предприятия
Забавен факт – Около 14,5% от глобалните парникови газове идват от флуктуацията на живите запаси и торовете.




Азотният диоксид (NO2), съставен от азот и кислород, е червен/кафяв газ с миризма, която е описана като дразнеща. Това е много отровен газ и е токсичен при вдишване и абсорбиране през кожата. Азотният диоксид е част от група газове, наречени азотни оксиди (NOx). Азотният диоксид обикновено се използва в приложения като производството на химически експлозиви и е окислител в ракетното гориво. Азотният диоксид има точка на топене 11,2 и точка на кипене 21,1 по Целзий.
Азотният диоксид се образува при изгарянето на изкопаеми горива. Това значително увеличава замърсяването на въздуха, допринасяйки значително за глобалното затопляне и озоновия слой заедно с шест други замърсители (име). Подобно на азотния оксид, азотният диоксид също е част от киселинния дъжд. В световен мащаб се обръща голямо внимание на намаляването на нивото на замърсители в околната среда на земята, за да се забави глобалното затопляне.
Британското правителство заявява, че азотният диоксид има неблагоприятен ефект върху човешкото здраве и може да намали очакваната продължителност на живота. Има доказано вредно въздействие върху белите дробове и може да увеличи възпалението в дихателните пътища, да предизвика астматични пристъпи и да намали белодробната функция. Доказано е, че NO2 причинява белодробен оток при хора – натрупване на прекомерно количество течност в белите дробове. Проучванията също предупреждават, че азотният диоксид има вероятност да причини астма при деца.
Забавен факт – Нивата на азотен диоксид могат да бъдат свързани с някои от най-натоварените зони в света по отношение на трафика по пътищата. Например Лос Анджелис и Чикаго, и двете силно пътуващи области и страни като Китай, имат едни от най-високите открити нива на азотен диоксид във въздуха.
Озонът (O3) е естествено срещащ се безцветен газ без мирис, съставен от три молекули кислород (O3). Това се случва в стратосферата над Земята и тропосферата близо до повърхността. Газът озон (O3) е миришещ и невидим, вариращ в нюанс от безцветен до син. Излагането на озон е свързано с различни неблагоприятни последици за здравето, включително главоболие, кашлица, сухота в гърлото, задух, стягане в гърдите и натрупване на течност в белите дробове. Засилените признаци и симптоми могат да бъдат резултат от продължителна експозиция. При продължителна експозиция може да се развие астма. Излагането на озон може да бъде вредно за работниците. Дозата, продължителността на времето и естеството на работата допринасят за общото количество на експозиция.
Кристиан Фридрих Шьонбайн, немско-швейцарски химик, за първи път идентифицира и изолира озона (O3) през 1839 г.
- Една молекула озон има три кислородни атома, докато една молекула кислород се състои само от два атома.
- Емисиите от моторни превозни средства и синтезът на природен газ допринасят за образуването на опасен приземен озон.
- Агенцията за опазване на околната среда предупреждава, че излагането на нива на озон от 70 ppb или по-високи за 8 часа или повече може да има неблагоприятни последици за здравето.
Те са склонни да се събират в градските райони, когато времето е топло и стабилно. - Използвайки гръцката дума за “мирис” озон, Шьонбайн дава името на този газ.
- Отрицателният приземен озон се създава, когато летливите органични съединения се комбинират с газовете азотни оксиди, отделяни от превозни средства и фабрики (съдържащи въглерод химикали, които се изпаряват бързо във въздуха, като разредители за бои).
Забавен факт – Озонът в стратосферата абсорбира по-голямата част от ултравиолетовото лъчение от Слънцето. Без озон, интензивната UV радиация на Слънцето би стерилизирала земната повърхност.


Органичните пари (OV) са течности на петролна основа, които се изпаряват и създават пара във въздуха. Те са на въглеродна основа и разтварят други вещества. Те са най-често срещани в строителната и производствената промишленост, тъй като са страничен продукт от производството на много битови и промишлени продукти.
Органичните изпарения могат да идват от продукти като бензин, епоксидна смола на основата на разтворител и разредител за боя, но също така се използват по-често за производство на продукти като почистващи продукти, бои и лепила. Тези продукти могат да разпръснат по-голям обем органични изпарения от други. Работата с газове като толуен, хлор, хлороводород и серен диоксид също включва риск от органични изпарения. Органичните изпарения представляват риск за хората, когато са прекомерно изложени. Това може да се случи чрез вдишване на пари, тъй като разтворителите се изпаряват, които след това се вдишват в белите дробове и се разпространяват в кръвния поток. Честите симптоми на излагане на органични изпарения включват главоболие, дезориентация, сънливост и гадене. Това обаче може да се развие в дългосрочни проблеми като проблеми с паметта, слабост и затруднения в концентрацията.
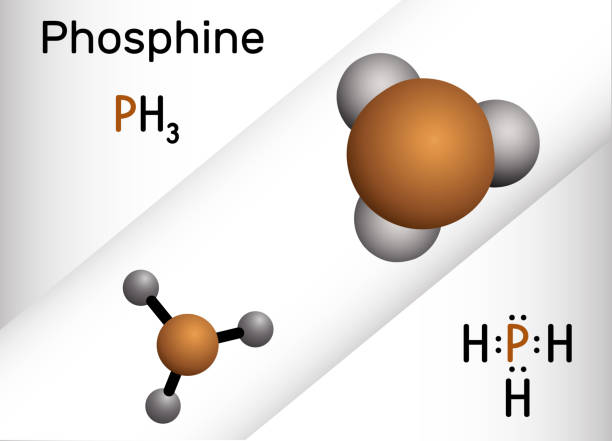
Фосфинът (PH3), известен като фосфид, е безцветен, запалим, силно отровен газ с мирис на чесън. Въпреки че фосфинът е структурно идентичен с амоняка (NH3), той е значително по-лош разтворител и е много по-малко водоразтворим.
Когато силна основа или гореща вода реагира с бял фосфор или когато водата реагира с калциев фосфид (Ca3P2), се генерира фосфин. Фосфинът (PH3) има точка на кипене от -126°F и точка на замръзване от -209°F. В изключително малки количества той е изключително отровен при вдишване. Освен това продължителното нагряване може да причини бурна експлозия на контейнери, което да доведе до възможни наранявания или смърт. Работници, изложени на фосфин в дългосрочен план, могат да имат дразнене на носа и гърлото, слабост, замаяност, гадене, стомашно-чревни, кардиореспираторни, симптоми на централната нервна система, жълтеница, чернодробни ефекти и повишена костна плътност.
Забавен факт – Фосфинът често излъчва рибен аромат.

Серният диоксид (SO2) е тежък, безцветен, отровен газ, който мирише остро – като кибритена клечка при първото запалване и се счита за токсичен и корозивен химикал. Серният диоксид е комбинация от сяра и кислород, създадена предимно чрез производство на сярна киселина и изгаряне на серни горива. Има точка на топене -75,5 по Целзий и точка на кипене -10.
Приложения като въглищни и електроцентрали, петролни рафинерии и изпарения от дизелови автомобили и машини допринасят значително за създаването на серен диоксид. Доказано е също, че стартирането, спирането и ремонтите на петролни рафинерии повишават нивата. Въпреки това, SO2 съществува естествено и във вулканични газове, водата от топли извори в минимални нива на атмосферата. Доказано е, че природни бедствия като горски пожари освобождават значителни нива на серен диоксид в атмосферата. SO2, заедно с азотния диоксид и азотния оксид, е основен компонент на киселинния дъжд. SO2 може да повлияе отрицателно на хората чрез дразнене на очите, носа и устата, а симптомите могат да включват кашлица и задушаване.
Забавен факт – Серният диоксид се използва в селското стопанство за обработка на зеленчуци, като унищожава плесени и действа като консервант.
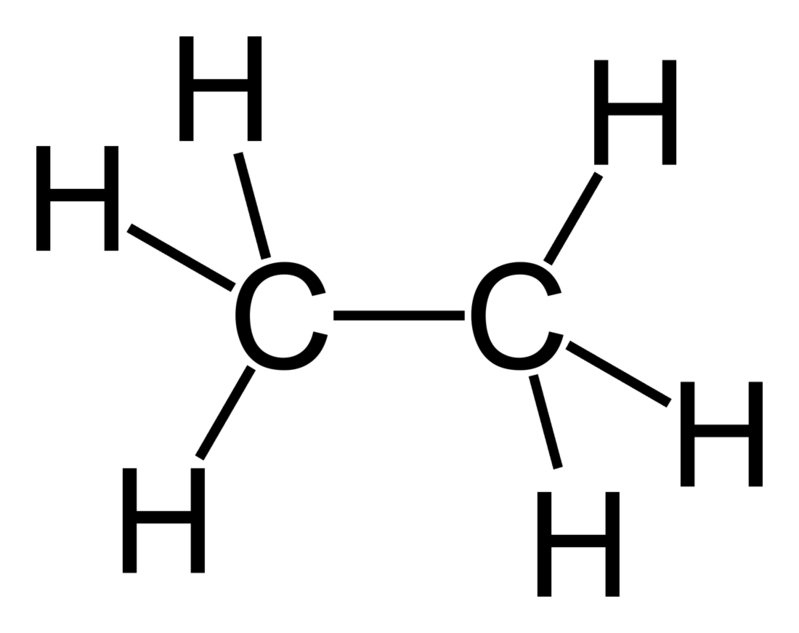
Етанът (C2H6), подобно на метана, пентана и бутана, е въглеводород без цвят и мирис. Той също така съставлява част от природния газ и е най-известен с присъствието си в петрола и е страничен продукт от петролните рафинерии. Етанът може да бъде втечнен под налягане или при понижени температури, за да бъде отделен от природния газ. Етанът е въглеводород заедно с метана и пентана и, когато се подлага на изгаряне на въглеводороди, отделя топлина.
Въпреки че етанът е парников газ като метана, той съществува в много по-малки количества, тъй като има много по-малък живот спрямо метана, няколко месеца в сравнение с 10+ години. Етанът също не е толкова широко използван в горивото. Вместо това етанът се използва най-популярно за производството на етилен. Етанът може да се преобразува в етилен и водород чрез пиролиза или парен крекинг през горещи тръби. Точката на топене на етана е -183 по Целзий, а точката му на кипене е -39. Освен това е суровина за нефтохимикали и се използва за създаване на продукти като полиетиленова пластмаса, етиленгликол и етилов алкохол. Етанът може да се използва и като хладилен агент за много ниски температури. Често се използва в производството на антифриз и перилни препарати.
Забавен факт – Етан е открит в атмосферата на луната на Сатурн, титан.